Pile à combustible à oxyde solide
Les piles à combustibles à oxydes solides sont prévues principalement pour les applications stationnaires avec une puissance de sortie allant de 1 kW à 2 MW.

Catégories :
Pile à combustible - Propulsion alternative - Énergie renouvelable - Utilisation durable des ressources naturelles - [+]
Recherche sur Google Images :

Source image : www.nrc-cnrc.gc.ca Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Intitulé de la thèse : Conducteurs Mixtes Nanostructurés pour les Piles à combustible à Oxyde Solide (SOFC) : Élaboration et Performances de Nouvelles... (source : graduateschool.paristech)
- La pile à combustible SOFC. Mieux exploiter les énergies fossiles, ... les promesses de la pile à combustible à oxyde solide SOFC (Solid Oxide Fuel Cell).... (source : saint-gobain)
- ... En matière de piles à combustible, CanmetÉNERGIE travaille principalement sur la pile à combustible à oxyde solide (SOFC) et , ... (source : canmetenergy-canmetenergie.nrcan-rncan.gc)
Introduction
Les piles à combustibles à oxydes solides (ou SOFC selon l'acronyme anglais de Solid oxide fuel cells) sont prévues principalement pour les applications stationnaires avec une puissance de sortie allant de 1 kW à 2 MW. Elles fonctionnent à particulièrement hautes températures, typiquement entre 700 °C et 1 000 °C (973 et 1273 K). Leurs rejets gazeux peuvent être utilisés pour alimenter une turbine à gaz secondaire afin d'accroître le rendement électrique. Le rendement peut atteindre les 70 % dans les dispositifs hybrides, nommés dispositifs à chaleur et puissance combinées (en anglais : combined heat and power device ou CHP). Dans ces piles, les ions oxygène sont déplacés au travers d'un oxyde solide pris comme électrolyte à haute température pour réagir avec l'hydrogène du côté anode. À cause de la haute température de fonctionnement des SOFC, il n'y a pas besoin de catalyseur onéreux, ce qui est le cas des piles à combustible à membrane échangeuse de protons (du platine par exemple). Ce qui veut dire que les SOFC ne subissent pas d'empoisonnement catalytique par le monoxyde de carbone, et cela en fait donc des piles hautement adaptables. Les SOFC ont été utilisés avec du méthane, du propane, du butane, du gaz de fermentation, de la biomasse gazéifiée et des vapeurs de peinture. Cependant, les composés soufrés présents dans le combustible doivent être éliminés avant de pénétrer dans la pile, ce qui peut être facilement fait grâce à un lit de charbon actif ou un absorbant à base de zinc.
L'expansion thermique demande un chauffage lent et uniforme à son début. Typiquement, 8 heures ou plus sont nécessaires. Des géométries micro-tubulaires permettent de raccourcir les temps de démarrage, typiquement jusqu'à 13 minutes .
Au contraire de la majorité des autres types de piles à combustible, les SOFC peuvent avoir de multiples géométries. Une géométrie plane est le type de géométrie en sandwich employée par la majorité des piles à combustible, dans laquelle l'électrolyte est "sandwichée" entre les électrodes. Les SOFC peuvent être construites selon une géométrie tubulaire par laquelle l'air ou le combustible est amené à passer à l'intérieur du tube et l'autre gaz par l'extérieur. Le profil tubulaire est avantageux car il y est plus facile de sceller le combustible et de le séparer de l'air que dans une géométrie plane. La performance de la géométrie plane est aujourd'hui plus importante que celle de la géométrie tubulaire cependant, à cause de sa plus faible résistance.
Fonctionnement de la SOFC
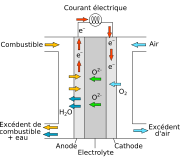
Une SOFC est constituée de quatre couches, trois d'entre elles étant des céramiques (d'où leur nom). Une pile unique constituée de ces quatre couches juxtaposées possède une épaisseur typique de quelques millimètres. Des centaines de ces piles sont alors juxtaposées en série pour former ce que le grand public nomme "pile à combustible à oxyde solide". Les céramiques utilisées dans les SOFC ne deviennent actives électriquement et ioniquement que quand elle atteignent une très haute température, et , donc, les empilements doivent atteindre des températures de l'ordre de 600 à 1 200 °C.
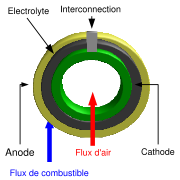
Cathode
La couche céramique de la cathode doit être poreuse, ce autorise l'air d'y circuler, mais aussi dans l'électrolyte. Il y a différents types de matériaux céramiques utilisés pour la cathode, mais tous doivent être conducteurs électriques. La cathode est le côté négatif de la pile au travers duquel les électrons circulent. C'est le côté exposé à l'air dont le rôle est d'utiliser des électrons pour diminuer les molécules d'oxygène de l'air (O2) en ion oxygène (O2-).
Électrolyte
L'électrolyte est la couche dense et imperméable aux gaz de chaque pile qui agit comme une membrane séparant le combustible du côté de l'anode de l'air du côté de la cathode. Il y a de nombreux matériaux céramiques étudiés pour leur utilisation comme électrolyte, mais les plus communs sont basés sur l'oxyde de zirconium. En plus d'être imperméable au gaz, l'électrolyte doit être un isolant électrique : les électrons résultant de la réaction d'oxydation du côté anode sont contraints à se déplacer au travers du circuit externe avant de rejoindre le côté cathode. Le requis principal pour l'électrolyte, cependant, est qu'il doit être capable de conduire les ions oxygène de la cathode vers l'anode. Pour cette raison, la fiabilité d'un matériau électrolytique se mesure en termes de conductivité ionique.
Anode
La couche céramique constituant l'anode doit être particulièrement poreuse pour permettre au combustible d'atteindre l'électrolyte. À l'instar de la cathode, elle doit conduire l'électricité. Le matériau le plus fréquemment utilisé est un cermet constitué de nickel mélangé avec le matériau céramique utilisé pour l'électrolyte dans cette pile spécifique. L'anode est couramment la couche la plus profonde et la plus solide de chaque pile individuelle, et est quelquefois celle qui apporte les propriétés mécaniques. D'un point de vue électrochimique, le rôle de l'anode est d'utiliser les ions oxygène diffusant dans l'électrolyte afin d'oxyder le combustible (hydrogène). La réaction d'oxydation entre les ions oxygène et le combustible (hydrogène) produit de l'eau et de l'électricité.
Interconnexion
L'interconnexion peut être une couche métallique ou céramique disposée entre chaque pile individuelle. Son rôle est d'assurer une connexion en série de chaque pile, combinant ainsi la production de chacune. À cause de son exposition aux cotés réducteurs et oxydants de chaque pile aux hautes températures, l'interconnexion doit être extrêmement stable. C'est pourquoi les céramiques sont plus stables sur le long terme que les métaux comme matériaux d'interconnexion. Cependant, ces céramiques sont particulièrement onéreuses. Heureusement, les matériaux métalliques peu coûteux deviennent plus intéressants au fur et à mesure que les SOFC à plus basse température (600 à 800 °C) sont développées.
La recherche sur les SOFC
La recherche est aujourd'hui orientée vers les SOFC fonctionnant à "basse" température (vers 600 °C) dans l'objectif de décroître les coûts, en donnant la possibilité l'utilisation de matériaux métalliques avec de meilleurs propriétés mécaniques et une meilleur conductivité thermique.
La recherche vise aussi à diminuer les temps de démarrage afin d'implémenter les SOFC dans des applications mobiles. À cause de leur flexibilité vis-à-vis des combustibles utilisés, elles sont susceptibles de fonctionner avec du gazole partiellement reconstitué, ce qui en fait des unités auxiliaires potentielles pour certaines applications (camions réfrigérés).
Certaines grandes firmes développent des SOFC comme unités auxiliaires dans les automobiles. Des SOFC à hautes-températures généreront l'électricité indispensable pour un moteur pour le rendre plus petit et plus efficace. Les SOFC marchent avec le même gazole ou essence que le moteur aidé, et conserveront le conditionnement de l'air et les autres dispositifs électriques nécessaires en marche quand le moteur ne fonctionne pas (arrêts aux feux de signalisation, par exemple). D'autres produisent des SOFC par sérigraphie sur des matériaux céramiques peu chers, ou des turbines à gaz hybrides consommant du gaz naturel pour des applications de génération de puissance allant jusqu'au mégawatt (firme Rolls-Royce ).
Certaines industries développement une SOFC à bas coût ainsi qu'à basse température (500 à 600 °C) utilisant un oxyde de cérium et gadolinium à la place des actuelles céramiques industrielles standard (à base d'yttrium stabilisé et de zirconium), et qui permet d'utiliser de l'acier inoxydable pour supporter la céramique.
Actuellement, des chercheurs du laboratoire "Sciences chimiques de Rennes", en collaboration avec une équipe de l'Institut Laue Langevin, à Grenoble, et de l'université de Kyoto, au Japon, ont mis au point un nouvel oxyde qui ouvre la voie à des piles plus efficaces toujours.
Le nouveau composé est un oxyde constitué de fer et de strontium, de formule chimique SrFeO2. Son énorme atout, c'est précisément de pouvoir réagir avec ces mêmes ions oxygène dès 280 °C. Il prépare l'arrivée de piles à la fois plus robustes dans le temps et moins gourmandes en chaleur pour fonctionner.
Liens externes
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Solid-oxide fuel cell».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 29/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité